إلتهاب المفاصل الروماتويدي
الروماتويد

يد متضررة من التهاب المفاصل الروماتويدي
من أنواع التهاب المفاصل، ومرض مناعي ذاتي، ومزمن، ومتلازمة فلتي

الاختصاص طب الروماتزم

عقاقير
إيبوبروفين، وكلوروكين، وفالديكوكسيب، وميثوتركسيت، وفلوربيبروفين، وبنيسيلامين، وكيتوبروفين، وسيكلوسبورين، وأوكسابروزين، وإندوميتاسين، وديكلوفيناك، وفينوبروفين، وسولينداك، وأوروثيو الغلوكوز، وأداليموماب، وآزاثيوبرين، وتولميتين، وإتودولاك، وديفلونيزال، وهيدروكسي كلوروكوين، وأورانوفين، ونابروكسين، وإيتانرسبت، وبيروكسيكام، وثاليدوميد، وسلفاسالازين، وسيليكوكسيب، ونابوميتون، وآناكينرا، وكابتوبريل، وإنالابريل، وذهب، وأسبرين، وإتودولاك، وسولينداك، وميثيلبريدنيزولون، وبيروكسيكام، وفينوبروفين، وفلوربيبروفين، وتولميتين، وهيدروكسي كلوروكوين، ونابوميتون، وكيتوبروفين

|
التهاب المفاصل الرَثَيَانِي أو الداء الرثياني أو الالتهاب المفصلي الروماتويدي (Rheumatoid arthritis) هو مرض مزمن، من الأمراض الانضدادية التي تؤدي بالجهاز المناعي لمهاجمة المفاصل، مسببة التهابات وتدميرا لها. ومن الممكن أيضا أن يدمر جهاز المناعة أعضاء أخرى في الجسم مثل الرئتين والجلد. وفي بعض الحالات، يسبب المرض الإعاقة، مؤدية إلى فقدان القدرة على الحركة والإنتاجية. ويتم تشخيص المرض بواسطة تحاليل دم مخبرية مثل تحليل العامل الرثياني (rheumatoid factor) والأشعة المقطعية. ويتم التشخيص والمعالجة الطويلة للمرض بواسطة أخصائي طب الأمراض المفصلية، وهو المختص في علاج أمراض المفاصل والأنسجة المحيطة بها.
و تتوفر عدة طرق علاجية للمرض. منها ما هو غير دوائي مثل العلاج الطبيعي والعلاج المهني. أما العلاج الدوائي فيشمل عدة فئات مثل مسكنات الألم، مضادة الالتهاب(NSAIDs))، الكورتيزون ومشتقاته بالإضافة إلى الأدوية المعدله لطبيعة المرض ( DMARDs)) وكلها تساهم بشكل أو بآخر لوقف تقدم المرض ولمنع تدمير المفاصل. وفي الآونة الأخيرة، تم إضافة الأدوية الحيوية (biologics) وتحسنت معها فرص الشفاء. (روماتويد(Rheumatoid) فأصله يوناني ويعني التهاب المفاصل المصحوب بحمى روماتزمية. وأول من اكتشف المرض كان الدكتور الفرنسي أوقستين جاكوب لاندري-بيافويس (1772-1840) في عام 1800.
محتويات ة(من ويكيديا الموسوعة الح)
1 العلامات والأعراض
1.1 المفاصل
1.2 الجلد
1.3 الرئتين
1.4 الكلى
1.5 القلب والأوعية الدموية
1.6 أخرى
2 التشخيص
2.1 التشخيص التفريقي
3 العلاج
3.1 الأدوية المعدله لطبيعة المرض (ديمارد) (DMARDs)
3.1.1 العناصر الحيوية
3.2 مضادات الالتهاب والمسكنات
3.3 طرق وعلاجات أخرى
4 علم الأوبئة
5 انظر أيضا
6 المصادر
العلامات والأعراض
التهاب المفاصل الروماتويدي في البداية يصيب المفاصل وايضاً يصيب بعض اعضاء الجسم الاخرى في الافراد بنسبة 15% - 25%.
المفاصل
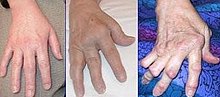
تأثير المرض على الأيادي
السبب الرئيسي لالتهاب المفاصل -الناشيء عن الداء الرثياني- هو التهاب الغشاء الزلالى(السينوفيلي) المبطن للمفصل وأغشية الأربطة العضلية. حيث يصيب المفاصل ويحث حرارة وألم وانتفاخ مع الحركة أو اللمس، وتصلب مما يعوقها عن الحركة. ومع الوقت يصيب المرض عدة مفاصل في الجسم،غالباما يصيب المفاصل الصغيرة (مفاصل راحة اليد، والقدم)ثم المفاصل كبيرة الحجم مثل الركبتين والكوعين والكتف ونادرا ما يصيب الفقرات الصدرية والقطنية ويصيب الفقرات العنقية في الحالات الشديدة من المرض ويختلف الأمر من شخص لآخر. يؤدي التهاب الغشاء المفصلي إلى التصاق الأنسجة وتحديد حركة المفصل ثم يبدأ المفصل في التآكل مما يشوه المفصل ويفقده وظيفتة.
ويظهر الداء الرثياني في المفصل المصاب في صورة التهاب، انتفاخ, حرارة، ألم وتيبس في المفاصل خصوصا في الصباح الباكر عند الاستيقاظ، أو بعد القيام بأعمال مرهقة. والتيبس المتزايد في الصباح الباكر والتي تستمر لمدة ساعة تقريبا أو أكثر، هي أوضح مظاهر المرض. الماء الساخن وتحريك المفصل بصورة لطيفة تساعد على تسكين الأعراض في المراحل الأولى من المرض.
تساعد هذه الأعراض في تمييز الداء الرثياني عن الالتهابات الأخرى التي تصيب المفاصل. يصيب المرض المفاصل بشكل متناسق على جانبي الجسم، على الرغم من أن ذلك ليس سمة مميزة للمرض، وأنه في مراحله الأولى يظهر بصورة غير متناسقة البداية على جانب واحد.
ومع تقدم مراحل المرض، يمتد الالتهاب ليؤدى إلى تآكل أربطة العضلات ونتوئها، وتدمير سطح المفصل، الذي يتسبب في تقليص مسحاة حركة المفصل, فينتج عن ذلك كله تشوه شكل المفصل. وتتأثر مفاصل اليد بمعظم أنواع التشوهات . فنجد من المصطلحات الطبية ما يشير إلى هذه الصور المختلفة للتشوهات، مثل "التواء الزند"، " تشوه بوتونيير"، "تشوه رقبة الإوزة"، و"إصبع حرف Z"، لكن هذه الأشكال لم تعد ذات أهمية في التشخيص أو الإعاقة بقدر أهمية العوامل الأخرى.
الجلد
النتوءات النسيجية الصلبة تحت الجلد في اليدين
الرئتين
يسبب الروماتويد تليف في الرئتين خاصة مع استعمال أدوية معينة تساعد في تكوين التليف.
متلازمة كابلان .
تجمع السوائل في الغشاء الرئوي
مرض الرئة الروماتويدي ومن اعراضة: التهاب الغشاء الرئوي, تجمع السوائل في الغشاء الرئوي, التهاب الاوعية الدموية داخل الرئة وغيرها ,,, ربع المصابين بالروماتويد يصابون بمرض الرئة الروماتويدي.
الكلى
يمكن ان يحدث الداء النشواني الكلوي نتيجة الالتهابات المزمنة.
يؤثر الروماتويد مباشرة على الكبيبة غالباَ من خلال اعتلالات في الاوعية الدموية او عن طريق ترسبات على الخلايا المحيطة بالكبيبة (وهو شئ غير مثبت كلياً لكنه متوقع لطبيعة المرض).
العلاج بالبنيسيلامين وأملاح الذهب هي أسباب معروفة لاعتلال الكلية الغشائي.
القلب والأوعية الدموية
الاشخاص المصابين بالروماتويد أكثر عرضة للاصابة بتصلب الشرايين وزيادة خطر:
الجلطات القلبية
والسكتات الدماغية.
من المضاعفات الممكن حدوثها ايضاً التهاب غشاء القلب الخارجي او الداخلي, ضعف البطين الايسر, التهاب الصمامات والتليف.
معظم مرضى الروماتويد لايشعرون بنفس الالم الذي يشعر به الاشخاص العاديين عند حدوث جلطة قلبية.
لتقليل مضاعفات الروماتيود على القلب, من الضروري التحكم بالالتهابات الناتجة عن الروماتويد عن طريق الادوية, وممارسة الرياضة وعلاج اي امراض اخرى قد تزيد من مضاعفات امراض القلب كزيادة ضغط الدم وزيادة الدهون.
أخرى
العين: التهابات وجفاف العين
الكبد: ارتفاع انزيمات الكبد
الدم: فقر الدم
الجهاز العصبي:اعتلال الاعصاب الطرفية مما يؤدي مبدئياً إلى الام في الاطراف ومن ثم فقد الاحساس فيها.
غالباً مايشكو المريض من متلازمة النفق الرسغي
الاعراض المصاحبة: الاعياء, ارتفاع حرارة الجسم, تصلب المفاصل خصوصاً بالصباح, فقدان الشهية, انخفاض الوزن.
العظام: هشاشة العظام .
زيادة في خطر الاصابة باورام الغدد اللمفاوية
التشخيص

أشعة مقطعية لتشوهات في اليد
الاشعة: عادة ماتجرى الاشعة السينية X-rays على اليدين والأقدام لمن يعاني من آلام بمفاصل متعددة بالجسم. يمكن آلا يكون هناك أي تغير بالمفاصل بالمراحل الأولى من المرض، ولكن مع تقدم المرض يمكن ملاحظة تأكل ,وخلع جزئي بالعظام.
يستخدم التصوير بالرنين المغناطيسي والموجات فوق الصوتية في متابعة تطور المرض.
فحوصات الدم: عندما الاشتباة بالروماتيود عند إجراء الفحص السريري يجب عمل تحليل RF مبدائياً. اذا كان التحليل سلبياً فهذا لا يعني بالضرورة عدم وجود المرض فـ15% من مرضى الروماتيود يكون فحص الRF سلبيا. غااباً ما يكون الـRF سلبياً في السنة الأولى من المرض ومن ثم يبدأ بالظهور بالسنوات اللاحقة. قد يكون الـRF موجوداً في أمراض أخرى كـ متلازمة شوغرن, التهاب الكبد C, الالتهابات المزمنة ويظهر ايضاً في 10% من الاشخاص السليمين. لهذا لايعتبر تحليلاً خاصاً للروماتويد فقط.
لهذا السبب تم تطوير تحاليل أخرى لتشخيص الروماتويد مثل ACPAs او anti-CCP. anti-CCP موجبة في 67% من مرضى الروماتيود ولكن نادراً ماتكون موجبة في غير مرض الروماتيود لذلك أي مريض موجب للـ anti-CCP يعتبر مريضاً بالروماتويد. هناك ايضاً بعض التحاليل التي عادة ماتعمل لبعض الأمراض التي تسبب اعراضاً مشابهة للروماتويد مثل الذئبة الحمراء.
التشخيص التفريقي
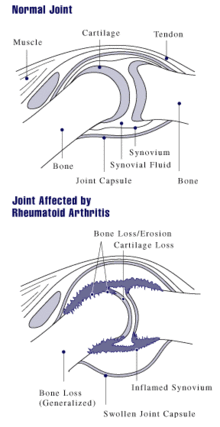
الفرق بين مفصل سليم وم فصل مصاب
يتشارك الروماتيد بأعراضة مع امراض اخرى مثل:
النقرس
الالتهاب العظمي المفصلي
الذئبة الحمراء
التهاب المفاصل عند مرضى الصدفية وغيرها من الأمراض
العلاج
لا يوجد علاج شافي للروماتويد لكن الأدوية تقلل من حدة الأعراض وتبطئ من تقدم المرض. الهدف من الأدوية تقليل حدة الأعراض مثل الآلام والانتفاخ ومنع تشوه العظام والمحافظة على نشاط الشخص اليومي من ـأن يتأثر بالمرض. ينصح باستخدام نوعين من الأدوية كحد أدنى في علاج الروماتويد كالمسكنات بالاضافة إلى الأدوية المضادة للروماتويد.
الأدوية المعدله لطبيعة المرض (ديمارد) (DMARDs)
يجب أن تعطى في المراحل الأولى للمرض فهي تقلل من تقدم المرض بشكل كبير وتقلل من المضاعفات.
ميثوتركسيت Methotrexate: من أفضل الأدوية وعادة ما يستخدم كبداية. يزيد من إنزيمات الكبد ويسبب تشوهات بالجنين لذلك تنصح المتزوجات بأخذ حبوب منع الحمل عند أخذه.
العناصر الحيوية
كـ انفليكسيماب وحاصرات انترليوكن 1 (infliximab & interleukin 1 blockers) تستخدم عادة مع تطور المرض ونقص كفاءة الميثوتركسيت وغيره من الأدوية.
مضادات الالتهاب والمسكنات
تقلل من الآلام والتصلب لكن لا تؤثر على تقدم المرض لذلك لا تعتبر من أدوية الخط الأول في العلاج. تستخدم بحذر مع مرضى الجهاز الهضمي والقلب والكلى.
يمكن استخدام الكورتيزون في ـثناء زيادة أعراض المرض بشكل مؤقت لكن لاينصح باستخدامها لمدة طويلة فقد تسبب هشاشة العظام وزيادة فرصة التعرض للالتهابات الجرثومية.
طرق وعلاجات أخرى
الجراحة: تغيير المفصل المصاب
علم الأوبئة

خريطة توضح انتشار الإعاقة بسبب مرض التهاب المفاصل الروماتويدي في العالم في ٢٠٠٤
حالات التهاب المفاصل في المنطقة هي 3 لكل 10000 شخص من السكان سنوياً. البداية تحت سن ال15 هي غير شائعة. منذ ذلك الحين ترتفع الحالات مع التقدم في العمر حتى سن ال80. إن معدل الانتشار هو 1% مع تضرر النساء من 3 إلى 5 مرات أكثر من الرجال.
انظر أيضا
التهاب المفاصل الرثياني الشبابي
سبل
متلازمة تسرب الأمعاء
مرض مترق
التهاب مفاصل الركبة
المصادر
Majithia V, Geraci SA (2007). "Rheumatoid arthritis: diagnosis and management". Am. J. Med. 120 (11): 936–9. PMID 17976416. doi:10.1016/j.amjmed.2007.04.005.
Efthimiou، P (2010). "Complementary and alternative medicine use in rheumatoid arthritis: proposed mechanism of action and efficacy of commonly used modalities.". Rheumatology international. 30 (5): 571–86. PMID 19876631. doi:10.1007/s00296-009-1206-y.
Turesson C, O'Fallon WM, Crowson CS, Gabriel SE, Matteson EL (2003). "Extra-articular disease manifestations in rheumatoid arthritis: incidence trends and risk factors over 46 years". Ann. Rheum. Dis. 62 (8): 722–7. PMC 1754626
 . PMID 12860726. doi:10.1136/ard.62.8.722.
. PMID 12860726. doi:10.1136/ard.62.8.722. Rheumatoid arthritis - Wikipedia, the free encyclopedia
.........
عامل الروماتويد
عامل الروماتويد (Rheumatoid factor) وأختصاره (RF) هو الأجسام المضادة الذاتية (الأجسام المضادة الموجهة ضد أنسجة الكائن الحي نفسه) وهو الأكثر أهمية في التهاب المفاصل الروماتويدي. ويعرف بأنه جسم مضاد ضد كريين مناعي ج. وينضم عامل الروماتويد مع كريين مناعي ج لتشكيل المعقدات المناعية التي تساهم في عملية المرض
محتويات
1 الاختبار
2 التفسير
3 لمحة تاريخية
4 مراجع
5 وصلات خارجية
الاختبار
غالبا ما يتم تقييم RF في المرضى الذين يشتبه في وجود أي شكل من أشكال التهاب المفاصل على الرغم من النتائج الإيجابية يمكن أن يكون راجعا إلى أسباب أخرى، ونتائج سلبية لا نستبعد المرض. ولكن، في تركيبة مع وجود علامات وأعراض، ويمكن أن تلعب دورا في كل من التشخيص والتشخيص المرض. إنه جزء من المعايير المعتادة مرض التهاب المفاصل الروماتويدي. وجود عامل الروماتويد في الدم يمكن أيضا أن تشير إلى حدوث نشاط المناعة الذاتية المشتبه بهم لا علاقة لها التهاب المفاصل الروماتويدي، مثل أن يرتبط مع الأنسجة أو رفض العضو. في مثل هذه الحالات، قد RF بمثابة واحدة من العديد من علامات المصلية للالمناعة الذاتية.
التفسير
عامل الروماتويد (RF) هو لبنة في تشخيص العديد من الأمراض الروماتيزمية وغير الروماتيزمية. فمن في الدم، وعادة ما يتم تحديد في المصل. عندما يكون هناك عامل الروماتويد الأجسام المضادة من الفئات الفرعية المختلفة (الغلوبولين المناعي، مفتش، ايغا، إيج) موجهة ضد مناطق محددة من الجسم المناعية الخاصة من فئة G (مفتش) إخراج (ضد جزء إف سي مفتش). وكثيرا ما يستخدم هذا المصطلح في صيغة الجمع (أي "عامل الروماتويد"). وهناك عامل الرثياني الإيجابي يجعل مرض الروماتيزم أكثر عرضة، وأنها لا يمكن أن تثبت. أيضا، يجعل من عامل الروماتويد سلبي الروماتويدي على الرغم من المحتمل، ولكن لا يستبعد ذلك. واحد يتحدث عن "سلبيين التهاب المفاصل الروماتويدي" اذا كان هذا المرض، "الروماتيزم" (التهاب المفاصل الروماتويدي) هو الحاضر، وعامل الروماتويد هو لا يمكن كشفها. تم العثور على عامل الروماتويد في تركيزات منخفضة حتى في حوالي 5٪ من الأشخاص الأصحاء (10٪ في الأشخاص الذين تتجاوز أعمارهم 60 عاما)، ومتلازمة سجوجرن وأمراض الكولاجين الأخرى، وأمراض الكبد (بما في ذلك التهاب الكبد C) أو المزمنة الأمراض المعدية. وثمة تحسنا كبيرا من مختبر تشخيص التهاب المفاصل الروماتويدي اكتشاف مستضدات citrullinated والأجسام المضادة ضد Peptid-/Protein-Antigene citrullinated (ACPA) وأهميته لتشخيص التهاب المفاصل الروماتويدي. تم العثور على هذه المستضدات الطبيعية داخل النسيج الزليلي ملتهبة والمستضدات التي تدور في السائل الزليلي من المرضى الذين يعانون من التهاب المفاصل الروماتويدي المنشأة، وتعتبر الأجسام المضادة لتكون ما يسمى المؤشرات الحيوية لالتهاب المفاصل الروماتويدي. الأكثر استخداما على نطاق واسع هنا هو معمل اختبار ELISA التي يكشف الاصطناعية الببتيدات citrullinated دوري. وقد أدى هذا دليل على ما يسمى الأجسام المضادة المقاومة للCCP إلى تحسن كبير في مختبر تشخيص التهاب المفاصل الروماتويدي، بما في ذلك تشخيص المراحل المبكرة من المرض. الأجسام المضادة لالببتيدات citrullinated يمكن أن يحتمل يتم الكشف سنوات قبل بداية ظهور أعراض المرض.أهمية إمراضي يمكن ولكن حتى الآن لم تظهر لمكافحة CCP. لم تثبت العلاقة بين عيار الأضداد المضادة للCCP ونشاط المرض في التهاب المفاصل الروماتويدي. وبالتالي فإن الأجسام المضادة CCP ليست مناسبة عن تدابير نتائج المرض. واحدة من مكافحة CCP ELISA حساسية التشخيص الجيد نسبيا في خصوصية انخفاض طفيف يوفر ELISA رواية تقوم على تحور citrullinated vimentin، MCV. الدراسات الأولية مع هذا النظام الاختبار تظهر علاقة التتر الأضداد المضادة لل MCV مع نشاط المرض وشدة التهاب المفاصل الروماتويدي. وسيتيح ذلك للأضداد MCV ضد الأجسام المضادة المقاومة للCCP لديها ميزة ارتباط مع نشاط المرض قد [2] وربما هي مناسبة أيضا لرصد التقدم المحرز العلاجية في التهاب المفاصل الروماتيزمي. [3] ومع ذلك، لتقييم نهائي ينبغي أن تكون أكثر النتائج يكون المنتظر من دراسة مستقلة أخرى
لمحة تاريخية
مراجع
"Rheumatoid Arthritis Symptoms". اطلع عليه بتاريخ 21 يونيو 2011.
وصلات خارجية
MedlinePlus on RFLabtestsonline page on RF...........
ما هو فحص ANA بواسطة: مروة حسون - آخر تحديث: ١٢:٠٤ ، ١٩ مارس ٢٠١٥ ما هو فحص ANA ذات صلة ما هو تحليل RF ما هو تحليل الإليزا ما معنى أجسام مضادة ما هو تحليل AFP فحص الأجسام المضادة للنواة (ANA)، (antinuclear antibodies)، والذي يهدف إلى تقييم بعض اضطرابات المناعة الذاتية، ليحدّد وجود الأجسام المضادة في الدّم، وذلك عن طريق أخذ عيّنة من الدّم المسحوب من الوريد في الذراع، ليتم تحليلها وقراءة النتائج التي تشير إمّ بنتيجة إيجابية أو سلبية. إذا كان الهدف من أخذ عينة الدّم فقط لاختبار (ANA)، فذلك يعني أنّه بالإمكان للشخص أن يأكل ويشرب قبل الاختبار، أمّا إذا كان سيتم استخدام عيّنة الدّم لإجراء فحوص إضافية فذلك قد يحتاج إلى الصيام لفترة من الوقت قبل الاختبار، وهذا ما سيعمل الطبيب المختص بإخباره للشخص كتعليمات تطلب منه قبل الاختبار. وغالباً ما يعمل الجهاز المناعي على محاربة العدوى، وفي المقابل فإنّ هناك أجسام مضادّة للنواة والتي تقوم بمهاجمة أنسجة الجسم وتحديداً نواة كل خليّة. الأجسام المضادة للنواة (ANA) هي مجموعة من الأجسام المضادة التي يقوم نظام المناعة بإنتاجها، وذلك عند فشله في التمييز بين المناعة الذاتية والمناعة غير الذاتية. تقوم هذه الخلايا بمهاجمة الخلايا السليمة في الجسم، لتتسبّب ببعض الأعراض والعلامات التي تظهر على الأنسجة والأعضاء، مثل انخفاض درجة حرارة الجسم، التعب المستمر، التهاب المفاصل، طفح جلدي، حساسية الجلد للضوء، فقدان الشعر، آلام في العضلات، خدر أو وخز في اليدين أو القدمين، التهاب وتلف الأعضاء والأنسجة، بما في ذلك الكليتين، الرئتين، القلب، الجهاز العصبي المركزي والأوعية الدموية. يتم استخدام اختبار الأجسام المضادة لنواة (ANA) كاختبار أولي للمساعدة في تقييم اضطرابات المناعة الذاتية التي تؤثر على العديد من الأنسجة والأعضاء في جميع أنحاء الجسم. اعتماداً على بعض العلامات والأعراض التي قد يعاني منها الشخص المصاب، يتم استخدام اختبار (ANA ) جنباً إلى جنب مع بعض الاختبارات الأخرى، حيث يتم الكشف عن وجود الأجسام المضادة التي تستهدف مواد محدّدة داخل نواة الخلية، وذلك بهدف مكافحة السنترومير، ومكافحة نويي، ومكافحة هيستون والأجسام المضادة لمكافحة الحمض النووي الريبي. كما ويستخدم هذا الاختبار بالتزامن مع التاريخ الطبي للشخص، وذلك للمساعدة في تشخيص الحالة ووصف العلاج المناسب لكل حالة مرضية. وعادةً ما تشير النتائج إلى الإيجابيّة وذلك يعني وجود الأجسام المضادّة، أي وجود أحد أمراض المناعة الذاتية، وأكثرها شيوعاً هو مرض الذئبة الحمراء. أمّا إذا كانت النتيجة سلبيّة فهذا يعني خلو الجهاز المناعي من أي مرض قد يصيبه، لكن يفضّل إعادة الاختبار أكثر من مرّة للتأكّد من النتيجة خاصة إذا كانت النتيجة سلبيّة وليست إيجابية. يوجد لدى بعض الأشخاص نتيجةَ فحص إيجابيةٍ دون وجود أي من أمراض المناعة الذاتيّة، فقد تصل نسبتهم إلى 5٪ من عينات الاختبار، فهذا التحليل لا تعني نسبة تركيزه ضرورة وجود مرض مُعيّن بحد ذاته من باب الحصر بل تشير إلى احتمالية وجود المرض وتجدر بنا الإشارة هنا بأنّ النتيجة الايجابيّة في الفحص قد تشير أحياناً إلى عدم وجود أي مرض من أمراض المناعة الذاتية، حيث يدل التحليل في تلك الحالة بعدم ضرورة تواجد مرض محدّد بعينه، حيث يعكس فقط احتماليّة وجود المرض فحسب.
ما هو فحص ANA بواسطة: مروة حسون - آخر تحديث: ١٢:٠٤ ، ١٩ مارس ٢٠١٥ ما هو فحص ANA ذات صلة ما هو تحليل RF ما هو تحليل الإليزا ما معنى أجسام مضادة ما هو تحليل AFP فحص الأجسام المضادة للنواة (ANA)، (antinuclear antibodies)، والذي يهدف إلى تقييم بعض اضطرابات المناعة الذاتية، ليحدّد وجود الأجسام المضادة في الدّم، وذلك عن طريق أخذ عيّنة من الدّم المسحوب من الوريد في الذراع، ليتم تحليلها وقراءة النتائج التي تشير إمّ بنتيجة إيجابية أو سلبية. إذا كان الهدف من أخذ عينة الدّم فقط لاختبار (ANA)، فذلك يعني أنّه بالإمكان للشخص أن يأكل ويشرب قبل الاختبار، أمّا إذا كان سيتم استخدام عيّنة الدّم لإجراء فحوص إضافية فذلك قد يحتاج إلى الصيام لفترة من الوقت قبل الاختبار، وهذا ما سيعمل الطبيب المختص بإخباره للشخص كتعليمات تطلب منه قبل الاختبار. وغالباً ما يعمل الجهاز المناعي على محاربة العدوى، وفي المقابل فإنّ هناك أجسام مضادّة للنواة والتي تقوم بمهاجمة أنسجة الجسم وتحديداً نواة كل خليّة. الأجسام المضادة للنواة (ANA) هي مجموعة من الأجسام المضادة التي يقوم نظام المناعة بإنتاجها، وذلك عند فشله في التمييز بين المناعة الذاتية والمناعة غير الذاتية. تقوم هذه الخلايا بمهاجمة الخلايا السليمة في الجسم، لتتسبّب ببعض الأعراض والعلامات التي تظهر على الأنسجة والأعضاء، مثل انخفاض درجة حرارة الجسم، التعب المستمر، التهاب المفاصل، طفح جلدي، حساسية الجلد للضوء، فقدان الشعر، آلام في العضلات، خدر أو وخز في اليدين أو القدمين، التهاب وتلف الأعضاء والأنسجة، بما في ذلك الكليتين، الرئتين، القلب، الجهاز العصبي المركزي والأوعية الدموية. يتم استخدام اختبار الأجسام المضادة لنواة (ANA) كاختبار أولي للمساعدة في تقييم اضطرابات المناعة الذاتية التي تؤثر على العديد من الأنسجة والأعضاء في جميع أنحاء الجسم. اعتماداً على بعض العلامات والأعراض التي قد يعاني منها الشخص المصاب، يتم استخدام اختبار (ANA ) جنباً إلى جنب مع بعض الاختبارات الأخرى، حيث يتم الكشف عن وجود الأجسام المضادة التي تستهدف مواد محدّدة داخل نواة الخلية، وذلك بهدف مكافحة السنترومير، ومكافحة نويي، ومكافحة هيستون والأجسام المضادة لمكافحة الحمض النووي الريبي. كما ويستخدم هذا الاختبار بالتزامن مع التاريخ الطبي للشخص، وذلك للمساعدة في تشخيص الحالة ووصف العلاج المناسب لكل حالة مرضية. وعادةً ما تشير النتائج إلى الإيجابيّة وذلك يعني وجود الأجسام المضادّة، أي وجود أحد أمراض المناعة الذاتية، وأكثرها شيوعاً هو مرض الذئبة الحمراء. أمّا إذا كانت النتيجة سلبيّة فهذا يعني خلو الجهاز المناعي من أي مرض قد يصيبه، لكن يفضّل إعادة الاختبار أكثر من مرّة للتأكّد من النتيجة خاصة إذا كانت النتيجة سلبيّة وليست إيجابية. يوجد لدى بعض الأشخاص نتيجةَ فحص إيجابيةٍ دون وجود أي من أمراض المناعة الذاتيّة، فقد تصل نسبتهم إلى 5٪ من عينات الاختبار، فهذا التحليل لا تعني نسبة تركيزه ضرورة وجود مرض مُعيّن بحد ذاته من باب الحصر بل تشير إلى احتمالية وجود المرض وتجدر بنا الإشارة هنا بأنّ النتيجة الايجابيّة في الفحص قد تشير أحياناً إلى عدم وجود أي مرض من أمراض المناعة الذاتية، حيث يدل التحليل في تلك الحالة بعدم ضرورة تواجد مرض محدّد بعينه، حيث يعكس فقط احتماليّة وجود المرض فحسب.
إقرأ المزيد على موضوع.كوم: https://mawdoo3.com/%D9%85%D8%A7_%D9%87%D9%88_%D9%81%D8%AD%D8%B5_ANA
فحص الأجسام المضادة للنواة (ANA)، (antinuclear antibodies)، والذي يهدف إلى تقييم بعض اضطرابات المناعة الذاتية، ليحدّد وجود الأجسام المضادة في الدّم، وذلك عن طريق أخذ عيّنة من الدّم المسحوب من الوريد في الذراع، ليتم تحليلها وقراءة النتائج التي تشير إمّ بنتيجة إيجابية أو سلبية. إذا كان الهدف من أخذ عينة الدّم فقط لاختبار (ANA)، فذلك يعني أنّه بالإمكان للشخص أن يأكل ويشرب قبل الاختبار، أمّا إذا كان سيتم استخدام عيّنة الدّم لإجراء فحوص إضافية فذلك قد يحتاج إلى الصيام لفترة من الوقت قبل الاختبار، وهذا ما سيعمل الطبيب المختص بإخباره للشخص كتعليمات تطلب منه قبل الاختبار. وغالباً ما يعمل الجهاز المناعي على محاربة العدوى، وفي المقابل فإنّ هناك أجسام مضادّة للنواة والتي تقوم بمهاجمة أنسجة الجسم وتحديداً نواة كل خليّة. الأجسام المضادة للنواة (ANA) هي مجموعة من الأجسام المضادة التي يقوم نظام المناعة بإنتاجها، وذلك عند فشله في التمييز بين المناعة الذاتية والمناعة غير الذاتية. تقوم هذه الخلايا بمهاجمة الخلايا السليمة في الجسم، لتتسبّب ببعض الأعراض والعلامات التي تظهر على الأنسجة والأعضاء، مثل انخفاض درجة حرارة الجسم، التعب المستمر، التهاب المفاصل، طفح جلدي، حساسية الجلد للضوء، فقدان الشعر، آلام في العضلات، خدر أو وخز في اليدين أو القدمين، التهاب وتلف الأعضاء والأنسجة، بما في ذلك الكليتين، الرئتين، القلب، الجهاز العصبي المركزي والأوعية الدموية. يتم استخدام اختبار الأجسام المضادة لنواة (ANA) كاختبار أولي للمساعدة في تقييم اضطرابات المناعة الذاتية التي تؤثر على العديد من الأنسجة والأعضاء في جميع أنحاء الجسم. اعتماداً على بعض العلامات والأعراض التي قد يعاني منها الشخص المصاب، يتم استخدام اختبار (ANA ) جنباً إلى جنب مع بعض الاختبارات الأخرى، حيث يتم الكشف عن وجود الأجسام المضادة التي تستهدف مواد محدّدة داخل نواة الخلية، وذلك بهدف مكافحة السنترومير، ومكافحة نويي، ومكافحة هيستون والأجسام المضادة لمكافحة الحمض النووي الريبي. كما ويستخدم هذا الاختبار بالتزامن مع التاريخ الطبي للشخص، وذلك للمساعدة في تشخيص الحالة ووصف العلاج المناسب لكل حالة مرضية. وعادةً ما تشير النتائج إلى الإيجابيّة وذلك يعني وجود الأجسام المضادّة، أي وجود أحد أمراض المناعة الذاتية، وأكثرها شيوعاً هو مرض الذئبة الحمراء. أمّا إذا كانت النتيجة سلبيّة فهذا يعني خلو الجهاز المناعي من أي مرض قد يصيبه، لكن يفضّل إعادة الاختبار أكثر من مرّة للتأكّد من النتيجة خاصة إذا كانت النتيجة سلبيّة وليست إيجابية. يوجد لدى بعض الأشخاص نتيجةَ فحص إيجابيةٍ دون وجود أي من أمراض المناعة الذاتيّة، فقد تصل نسبتهم إلى 5٪ من عينات الاختبار، فهذا التحليل لا تعني نسبة تركيزه ضرورة وجود مرض مُعيّن بحد ذاته من باب الحصر بل تشير إلى احتمالية وجود المرض وتجدر بنا الإشارة هنا بأنّ النتيجة الايجابيّة في الفحص قد تشير أحياناً إلى عدم وجود أي مرض من أمراض المناعة الذاتية، حيث يدل التحليل في تلك الحالة بعدم ضرورة تواجد مرض محدّد بعينه، حيث يعكس فقط احتماليّة وجود المرض فحسب
إقرأ المزيد على موضوع.كوم: https://mawdoo3.com/%D9%85%D8%A7_%D9%87%D9%88_%D9%81%D8%AD%D8%B5_ANA
Abstract
الكلية الأمريكية لأمراض الروماتيزم في بيان موقف اختبار ANA ينص على استخدام IIF كأسلوب المعيار الذهبي لفحص ANA 1. على الرغم من أن معهد التمويل الدولي هو اختبار الفحص ممتازة في أيدي الخبراء، والصعوبات التقنية لمعالجة وقراءة الشرائح معهد التمويل الدولي - مثل تجهيز العمل المكثف الشرائح، قراءة دليل، والحاجة إلى ذوي الخبرة والتقنيين المدربين واستخدام غرفة مظلمة - جعل الأسلوب معهد التمويل الدولي من الصعب احتواؤها في سير العمل، والمختبرات الآلي الحديثة.
الخطوة الأولى والحاسمة تجاه جودة عالية ANA الفحص هو تجهيز الشريحة حذرا. هذا الإجراء هو العمل المكثف، ويتطلب الفهم الكامل لهذه العملية، وكذلك الانتباه إلى التفاصيل والخبرة.
يتم تنفيذ القراءة الشريحة بواسطة المجهر الفلورسنت في غرف مظلمة، ويتم ذلك عن طريق التقنيين المدربين الذين معتادا على أنماط مختلفة، في سياق دورة الخليةومورفولوجية البيني وتقسيم الخلايا. شريطة أن معهد التمويل الدولي هو أول أداة فحص خط التنمية الزراعية والريفية، وفهم الخطوات لتنفيذ هذه التقنية بشكل صحيح أمر بالغ الأهمية.
مؤخرا، تم تطوير أنظمة التصوير الرقمي للقراءة الآلية من الشرائح معهد التمويل الدولي. هذه الأنظمة، مثل NOVA مشاهدة الآلي نيون مجهر، وقد صممت لتبسيط سير العمل الروتينية معهد التمويل الدولي. عرض NOVA يكتسب ومخازن عالية الدقة الصور الرقمية من الآبار، وبالتالي فصل الحصول على الصور من التفسير؛ وينظر إلى الصور وتفسيرها على شاشات الكمبيوتر عالية الدقة. فإنه يخزن الصور كمرجع في المستقبل، وتدعم تفسير المشغل من خلال توفير البيانات الفلورسنت شدة الضوء على الصور. كما أنه يصنف مبدئيا النتائج بأنها إيجابية أو سلبية، ويوفر نمط الاعتراف للعينات الإيجابية. وباختصار، فإنه يلغي الحاجة إلى غرفة مظلمة، وبأتمتة ويبسط readi معهد التمويل الدولينانوغرام / تفسير سير العمل. الأهم من ذلك، لأنه يزيد من الاتساق بين القراء والقراءات. علاوة على ذلك، مع استخدام الشرائح barcoded، يتم استبعاد أخطاء النسخ من خلال توفير إمكانية التتبع وتحديد عينة إيجابية المريض. هذا يؤدي إلى زيادة تكامل البيانات وسلامة المريض.
الهدف العام من هذا الفيديو هو للتدليل على الإجراء معهد التمويل الدولي، بما في ذلك تجهيز الشريحة، والتعرف على أنماط معهد التمويل الدولي المشترك، وإدخال التطورات الجديدة إلى تبسيط ومواءمة هذه التقنية.
Introduction
الأجسام المضادة للنواة المدى (ANA) يصف مجموعة متنوعة من الأجسام المضادة التي تتفاعل مع مكونات نواة الخلية بما في ذلك الحمض النووي والبروتينات وribonucleoproteins 1، 2. الخلية التهاب الكبد-2، مجموعة البروتين الأصلي مع مئات من المستضدات، يوفر ركيزة مثالية للكشف عن ANA 1. الكشف عن ANA في مصل الدم البشري هو أداة مهمة لفحص أمراض النسيج الضام، ومعهد التمويل الدولي هو الأسلوب مرجعية لANA اختبار 1. مؤخرا، تم استبدال معهد التمويل الدولي على التهاب الكبد-2 في الخلايا المناعية بعض المختبرات مع مستضد محددة وأساليب متعددة. بسبب المخاوف من نتائج سلبية كاذبة وانعدام الشفافية للأطباء، والكلية الأمريكية لأمراض الروماتيزم شكلت فرقة العمل التي خلصت إلى أن معهد التمويل الدولي باستخدام خلايا التهاب الكبد-2 يجب أن يكون "المعيار الذهبي" لفحص ANA 1.
نظرا لطبيعة الشخصية للANA الفحص ونوعية التهاب الكبد-2 الخلايا فيtegral إلى تقارير دقيقة واثقة من النتائج. وجود عدد كبير من الخلايا الإنقسامية، مورفولوجيا الخلايا الأمثل، confluency كافية، والتعبير عن مستضدات ذات الصلة أهمية خاصة. يقدم معهد التمويل الدولي والتعرف على نمط كأداة مهمة للمساعدة في تشخيص المريض. فهم أهمية أنماط مختلفة تمكن الأطباء والعاملين في المختبرات المناسبة لأداء اختبار المتابعة لتأكيد التشخيص. على سبيل المثال، يمكن أن يحدث متجانسة نمط ANA بحضور مكافحة dsDNA والأجسام المضادة أو لونين، وربما تترافق مع الذئبة الحمامية الجهازية (SLE) 3. من الجانب الآخر، وصفت مؤخرا أن يسمى كثيفة نمط الأرقط غرامة (DFS) التي ينظر اليها عادة في ما يصل إلى 12٪ من عينات روتينية، ومعظمها ارتبطت الأجسام المضادة للDFS70. هذه الأجسام المضادة، عندما وجدت في عزلة (دون أخرى ANA بأمراض محددة) لا يرتبط مع الأمراض الروماتيزمية المناعة الذاتية الجهازية <سوب> 4-9. الاختبار التأكيدي بذلك عن الأجسام المضادة لمكافحة DFS70 يمكن أن تساعد في الحد من غير الضروري اختبار رد الفعل، وتقديم وفورات كبيرة في التكاليف، وتخفيف القلق المريض.
بالنظر إلى أن معهد التمويل الدولي هو أول منهجية الفحص للكشف عن الأجسام المضادة الخط، فإنه من الأهمية بمكان أن يفهم كيف للمستخدم اختيار الكواشف وركائز الأنسجة يمكن أن تؤثر على النتائج. منذ تقنية معهد التمويل الدولي هو ذاتي بطبيعتها، فمن المهم أن الكواشف المستخدمة توفير أعلى نوعية النتائج.
هذا الهدف من هذا البروتوكول الفيديو هو تعريف المستخدم مع الخطوات الصحيحة اللازمة لأداء الأسلوب معهد التمويل الدولي، والأنماط الشائعة المرتبطة ANA، وإدخال التطورات الجديدة التي يمكن تبسيط سير العمل وتوحيد النتائج المختبرية.
Protocol
1. عينة إعداد واختيار الركيزة
إزالة الكواشف من التعبئة والتغليف والسماح لكل بند أن يأتي إلى درجة حرارة الغرفة. إعداد الكواشف وتمييع الأمصال المريض وفقا لإدراج الاتجاه. ملاحظة: يتم barcoded الشرائح NOVA لايت ويمكن دمجها بسهولة في النظم الآلية بالاشتراك مع مختبر نظام المعلومات LIS. يوضح هذا الإجراء تجهيز الشريحة دليل؛ مختبرات إنتاجية عالية، ومع ذلك، قد تختار لمعدات تجهيز الشريحة الآلي.
2. إضافة الضوابط وعينات
الاستغناء 1 قطرة من السيطرة الإيجابية و1 قطرة من المراقبة السلبية إلى الآبار الشريحة المناسبة. ماصة 20-25 ميكرولتر من مصل المريض المخفف إلى الآبار المتبقية. معالجة شريحة واحدة في المرة الواحدة.
وضع الشريحة (ق) في وعاء تلطيخ مع منشفة ورقية مبللة في القاع. تغطية الحاويات واحتضان الشريحة (ق) لمدة 30 دقيقة. ملاحظة: سيتم الظروف الرطبةمنع الركيزة من الجفاف. جفاف الآبار يمكن أن يؤدي إلى تلطيخ مصطنعة. خلال هذه الفترة الحضانة، فإن الأجسام المضادة المناهضة للاسلحة النووية في مصل المريض ربط المستضدات للخلايا التي يتم إصلاحها على كل بئر.
بعد فترة الحضانة، شطف المصل باستخدام تيار لطيف من غسل العازلة. من أجل تجنب الإضرار الركيزة ومنع انتقال أكثر من عينات بين الآبار، وزاوية الشريحة قليلا لتجنب توجيه تيار مباشرة على الآبار. الاستفادة من غسل العازلة الزائدة ووضع الشريحة في جرة Coplin تحتوي على غسل العازلة لحوالي 5 دقائق.
3. إضافة نيون الاقتراني
واحدا تلو الآخر، وإزالة الشرائح من غسل العازلة والاستفادة بلطف لإزالة غسل العازلة الزائدة. تطبيق 1 قطرة من المكورات فلوري (FITC المسمى مفتش مكافحة الإنسان) على كل بئر. احتضان الشرائح لمدة 30 دقيقة في حاوية مرطب، وتأكد من استبدال تلطيخغطاء الحاوية. ملاحظة: للحصول على اختبار ANA، فمن المستحسن استخدام وسيلة محددة المكورات مفتش لكرة القدم. والمكورات هو الحساسة للضوء، وسوف غطاء حماية الشرائح من التعرض للضوء، بالإضافة إلى الحفاظ على البيئة مرطب. خلال هذه الفترة الحضانة، فإن المكورات ربط الأجسام المضادة المناهضة للاسلحة النووية المريض التي منضما إلى مستضدات الخلية. هذه المكورات نتائج ملزمة بحضور مضان في الآبار.
شطف وغسل الشريحة كما هو موضح أعلاه.
وضع ساترة على منشفة ورقية وتطبيق تصاعد المتوسطة في خط متواصل إلى الحافة السفلى من ساترة.
إزالة كل شريحة من غسل العازلة والاستفادة من الشريحة بلطف لإزالة غسل العازلة الزائدة. لمس الحافة السفلية من الشريحة إلى حافة ساترة.
خفض بلطف الشريحة على ساترة في مثل هذه الطريقة التي المتوسطة المتزايدة على ساترة يتدفق إلى الحافة العلوية من الشريحة دون تشكيل فقاعة الهواء. ملاحظة: التعاونverslipping، بما في ذلك استخدام كمية الأمثل للتصاعد المتوسطة، هو الاسلوب الذي يأخذ الممارسة لاتقان.
4. تحديد النتائج الإيجابية والسلبية
دليل تفسير
عرض الشرائح مع المجهر الفلورسنت، وتقع في غرفة مظلمة. تنفيذ مسح البئر بالكامل مع الهدف 20X 25X أو لتقييم توزيع الخلايا وتوحيد مضان
التبديل إلى الهدف 40X لجعل التفسير النهائي بشأن الإيجابية والنمط.
ننظر إلى الضوابط الإيجابية والسلبية. الإيجابية الصف باستخدام مقياس الدرجات تفاعل من 1 إلى 4 + +. ملاحظة: سيطرة سلبية قد لا تظهر مظلمة تماما، ولكن في كثير من الأحيان عرض مضان غير محدد مستوى منخفض. فإن السيطرة الإيجابية عرض التفاح مشرق مضان أخضر في النواة (الشكل 1).
التفسير الآلي
ملاحظة: في additiإلى تفسير مختصر، تحميل الشرائح وتفحص بواسطة NOVA مشاهدة الآلي الإسفار مجهر أو غيرها من أداة التصوير الرقمي الآلي؛ لا غرفة مظلمة هو ضروري. بعد إنشاء المشروع عن طريق تحديد نوع الشريحة المناسبة، يكتسب الصك ومخازن عالية الدقة الصور الرقمية من الخلايا في كل بئر. بالإضافة إلى ذلك، عرض NOVA يقيس شدة الضوء الفلورسنت، ويصنف النتائج بأنها إيجابية أو سلبية، ويوفر نمط الاعتراف للعينات الإيجابية. يتم عرض الصور من قبل المشغل على جهاز الكمبيوتر عالية الدقة، مما يتيح للالتفسير النهائي، ومراجعة وتأكيد NOVA عرض نتيجة. يمكن أن تتولد تقارير عن النتائج المؤكدة. وينبغي استخدام المجهر الرقمي بالتعاون مع فني مختبر من ذوي الخبرة لأنه معد للمساعدة في تفسير النتائج.
Representative Results
عند تقييم نتائج تلطيخ خلية لالتهاب الكبد-2، خمسة أنماط النووية الكبرى هي الأكثر شيوعا: متجانسة، الأرقط، السنترومير، نويي، والنقاط النووية. هذه الأنماط هي نتيجة الأجسام المضادة ملزمة للهيئات المكونة محددة من النواة. على الرغم من أن اختبار ANA غير محددة لهياكل النووية، ويمكن أيضا أن يلاحظ أنماط حشوية المرتبطة الأجسام المضادة ضد الهياكل حشوية. في بعض الحالات، قد يكون العديد من الأجسام المضادة الموجودة في العينة، ويمكن أن تظهر الصورة باعتبارها نمط مختلط.
هناك غيرها، لاحظ كثير من الأحيان أقل، وغالبا ما أنماط محددة دورة الخلية التي يمكن الكشف عنها بواسطة الأسلوب معهد التمويل الدولي؛ مؤخرا، وقد وصفت ما يسمى كثيفة نمط الأرقط مع غرامة أهمية سريرية خاصة في بعض الأمصال إيجابية ANA.
نمط متجانس
لتحديد نمط متجانس، تفحص جيدا وتحديد الإنقسامية أو الفاصلالخلايا. لونين مكثف من الخلايا الإنقسامية (الشكل 2، البرتقال السهم) يسلك الصلبة، مضان موحدة والتي غالبا ما تكون أكثر وضوحا مما كانت عليه في خلية يستريح nuclei.In نمط متجانس، ويستريح الخلايا المعرض موحدة، مضان منتشر للنواة بأكملها (الشكل 2، السهم الأبيض). هذا النمط مميزة وغالبا ما يكون نتيجة لأجسام مضادة لمكافحة dsDNA و10.
نمط الأرقط
في نمط الأرقط الخشنة، تظهر الخلايا الإنقسامية أي تلطيخ للمناطق الكروموسومات المختصرة (الشكل 3، البرتقال السهم). الخلايا الحبيبية مضان يستريح تظهر في جميع أنحاء نواة بأكملها. والتنقيط النووية يمكن تعريفها بأنها الخشنة أو الغرامة. نمط التنقيط الخشنة وغالبا ما يكون نتيجة لمكافحة-SM ومكافحة RNP 11.
في نمط الأرقط غرامة، تظهر الخلايا يستريح التنقيط الغرامة أو منتشر في جميع أنحاء نوى، وعادة في زي دistribution (الشكل 4، السهم الأبيض). نمط الأرقط غرامة وغالبا ما يكون نتيجة لمكافحة SSAand مكافحة SSB 12.
الكثيفة مبقع الجميلة نمط
من المسلم به الآن أن كثيفة نمط الأرقط غرامة (DFS) هو أمر شائع في الفحوصات الروتينية، وبقدر 12٪ من العينات إيجابية لمكافحة الأجسام المضادة DFS70. ومع ذلك، فإن هذه الأجسام المضادة، عندما وجدت في عزلة، لا يرتبط مع الأمراض الروماتيزمية المناعة الذاتية الجهازية 4 -6. هذه الأجسام المضادة هي السائدة في الأفراد والمرضى واضعة أمراض لا علاقة لها التنمية الزراعية والريفية 6 صحية. الاختبار التأكيدي لأجسام مضادة لمكافحة DFS70 يمكن أن تساعد في الحد من غير الضروري اختبار رد الفعل، وتقديم وفورات كبيرة في التكاليف، وتخفيف القلق المريض.
منذ نمط DFS من الصعب تحديد وANA الإيجابية يمكن أن يسبب القلق لكل من المرضى والأطباء، فمن المستحسن للغاية لإجراء اختبار تأكيدي بعد identi fying نمط موح من الأجسام المضادة المقاومة للDFS70 لتوضيح الأهمية السريرية لANA positivty 5،6.
في هذا النمط، والخلايا الإنقسامية (الشكل 5 والبرتقالي السهم) تظهر تلطيخ إيجابية الأرقط من لونين الطورية، في حين يستريح نواة الخلية (الشكل 5، السهم الأبيض) المعرض بقع غرامة وزعت بشكل موحد في جميع أنحاء النواة.
السنترومير نمط
لتحديد نمط السنترومير، مسح الآبار وتحديد الإنقسامية أو تقسيم الخلايا. في الخلايا الإنقسامية (الشكل 6، البرتقال السهم)، وهذه البقع تصبح منفصلة مرتبطة ارتباطا وثيقا في ما غالبا ما يوصف بأنه "شريط الطورية". في نمط السنترومير، ويستريح الخلايا (الشكل 6، السهم الأبيض) تظهر ما يقرب من 40-60 بقع منفصلة موزعة في جميع أنحاء نوى. نمط السنترومير هو نتيجة لمكافحة CENP A، B، C الأجسام المضادة 13. خطوة "> نمط نويي
وترتبط بعض أنماط نويي مع تلطيخ حشوية منتشر في الخلايا الإنقسامية (الشكل 7، البرتقال السهم) والمنطقة الكروموسومات السلبية، في حين عرض أنماط أخرى nucleolear تلطيخ إيجابية في المنطقة الكروموسومات. ويرتبط هذا النمط نويي مع تلطيخ متجانسة أو الأرقط من نويات (الشكل 7، السهم الأبيض)، جنبا إلى جنب مع ضعف الأرقط أو تلطيخ متجانسة من جبلة النواة. وترتبط هذه الأنماط مع مكافحة الحمض النووي الريبي بوليميراز الثالث، ومكافحة fibrillarin، anti-Th/To وanti-PM/Scl الأجسام المضادة 14،15.
دوت النووية نمط
ويرتبط نمط نقطة النووية مع الخلايا السلبية الطورية الإنقسامية (الشكل 8 والبرتقالي السهم) ومع عدد قليل من بقع منفصلة في نواة الخلية يستريح (الشكل 8، السهم الأبيض). هذا النمط مميزة وغالبا ما يكون نتيجة لSP-100، الرابطة الاسلامية، أو P80 الأجسام المضادة كولن. هذه الأجسام المضادة هي على النحو sociated مع التشمع الصفراوي الابتدائي والتهاب الكبد الذاتية 16.

. الرقم 1 السيطرة السلبية (إلى اليسار): خلايا عرضه انخفاض مستوى مضان غير محددة، ولكن لا تلطيخ النووية الرقابة المحددة الإيجابية (اليمين): عرض خلايا التفاح الأخضر مضان النووية.

الشكل 2. نمط متجانسة. الخلايا الميتوزى (orangearrow) تظهر مضان الصلبة. تظهر الخلايا يستريح حتى، وتلطيخ منتشر (whitearrow).
"العرض =" 500 "/>
الرقم 3. الأرقط الخشنة النمط. الخلايا الميتوزى (السهم البرتقالي) تظهر تلطيخ السلبية. تظهر الخلايا يستريح وصمة عار الأرقط متميزة (السهم الأبيض).

الشكل 4. نمط الجميلة الأرقط. الخلايا الميتوزى (السهم البرتقالي) تظهر تلطيخ السلبية. تظهر الخلايا يستريح على تلطيخ الأرقط غرامة متميزة (السهم الأبيض).

الرقم 5. الكثيفة نمط غرامة الأرقط. الخلايا الميتوزى (السهم البرتقالي) تظهر تلطيخ الصلبة الحبيبية غرامة. تظهر الخلايا يستريح غرامة جدا، وصمة عار الأرقط منتشر (whitearrow).
ogether.within صفحة = "دائما">

الرقم 6. نمط السنترومير. الخلايا الميتوزى (orangearrow) عرض موحد، بقع منفصلة. يستريح الخلايا (whitearrow) يظهر بقع منفصلة 40-60 في نواة الخلية.

الرقم 7. نمط نويي. الخلايا الميتوزى (orangearrow) تظهر مجموعات كبيرة اعتبارا من تلطيخ الحبيبية. يستريح الخلايا nucleishows مضان في نويات (whitearrow).

الرقم 8. نمط نقطة النووية. الخلايا الميتوزى (orangearrow) تظهر سلبية. تظهر الخلايا يستريح بضع discrبقع مؤسسة التدريب الأوروبية في النواة (whitearrow). بالإضافة إلى ذلك، فإن نمط نقطة nucelar يمكن أن تتعايش مع تلطيخ حشوية المرتبطة الأجسام المضادة لمستضدات الميتوكوندريا (السهم الأحمر).
Disclosures
المؤلفين غابرييلا Lakos، كاساندرا براينت، كارول بوخنر، وآنا اسلامي هم موظفون من INOVA التشخيص.
Acknowledgements
نشكر كاساندرا براينت لأداء التجربة معهد التمويل الدولي وكارول بوخنر لها الاستعراض التقني الخبير.
Materials
Name Company Catalog Number Comments
NOVA Lite HEp-2 IgG (DAPI conjugate) INOVA Diagnostics 708102
NOVA View Instrument INOVA Diagnostics NV2000
QUANTA Link Workstation INOVA Diagnostics LINK010
QUANTA Link Workstation License INOVA Diagnostics LINK001
Barcode Scanner INOVA Diagnostics LINK019
DOWNLOAD MATERIALS LIST
References
Meroni, P. L., Schur, P. H. ANA screening: an old test with new recommendations. Ann Rheum Dis. 69, (8), 1420-1422 (2010).
Tan, E. M. Autoantibodies to nuclear antigens (ANA): Their immunobiology and medicine. Advances in immunology. 33, 167-240 (1982).
Sack, U., et al. Autoantibody detection using indirect immunofluorescence on HEp-2 cells. Ann NY Acad Sci. 1173, 166-173 (2009).
Watanabe, A., et al. Anti-DFS70 antibodies in 597 healthy hospital workers. Arthritis Rheum. 50, (3), 892-900 (2004).
Mahler, M., et al. Importance of the dense fine speckled pattern on HEp-2 cells and anti-DFS70 antibodies for the diagnosis of systemic autoimmune diseases. Autoimmun Revi. 11, (9), 642-645 (2012).
Mahler, M., Fritzler, M. J. The clinical significance of the dense fine speckled immunofluorescence pattern on HEp-2 cells for the diagnosis of systemic autoimmune diseases. Clin Dev Immunol. (2012).
Miyara, M., et al. Clinical phenotypes of patients with anti-DFS70/LEDGF antibodies in a routine ANA referral cohort. Clin Dev Immunol. (2013).
Mariz, H., et al. Pattern on the antinuclear antibody-HEp-2 test is a critical parameter for discriminating antinuclear antibody positive healthy individuals and patients with autoimmune rheumatic diseases. Arthritis Rheum. 63, (1), 191-200 (2011).
Muro, Y., et al. High concomitance of disease marker autoantibodies in anti-DFS70/LEDGF autoantibody-positive patients with autoimmune rheumatic disease. Lupus. 17, (3), 171-176 (2008).
Agmon-Levin, N., et al. International recommendations for the assessment of autoantibodies to cellular antigens referred to as anti-nuclear antibodies. Ann Rheum Dis. 73, (1), 17-23 (2014).
Craft, J., et al. The U2 small nuclear ribonucleoprotein particle as an autoantigen. J Clin Invest. 81, (6), 1716-1724 (1998).
Salomonsson, S., et al. A serologic marker for fetal risk of congenital heart block. Arthritis Rheum. 46, (5), 1233-1241 (2002).
Miyawaki, S., et al. Clinical and serological heterogeneity in patients with anticentromere antibodies. J Rheumatology. 32, (8), 1488-1494 (2005).
Raijamkers, R., et al. PM-Scl-75 is the main autoantigen in patients with the polymyositis/scleroderma overlap syndrome. Arthritis Rheum. 50, (2), 565-569 (2004).
Yang, J. M., et al. Human scleroderma sera contain autoantibodies to protein components specific to the UC small nucleolar RNP complex. Arthritis Rheum. 48, (1), 210-217 (2003).
Granito, A., et al. Antinuclear antibodies as ancillary markers in primary biliary cirrhosis. Expert Rev Mol Diagn. 12, (1), 65-74 (2012).
Comments
0 Comments
Post a Question / Comment / Request
You must be signed in to post a comment. Please sign in or create an account.
Usage Statistics
=====
اختبارات Autoantibody

مصنف فى : علم المناعة و المصليات
بتاريخ : 31 مارس 2011
بقلم : خالد
الزيارات : 36٬781 زيارة
التقييم :

Anti Nuclear Antibodies :
تحليل ANA وهو اختصار Anti Nuclear Antibodies وهو يدخل تحتها كل الأجسام المضادة لكل مكونات النواة مثل Anti DNA وغيرها وتكون إيجابية للمصابين بـ SLE الذي يعتبر تشخيصياً لعدم وجودها في حالة السلبية أما في حالة الإيجابية للاختبار لا يعتبر تشخيصياً أي لا تثبت الإصابة بـ SLE ولكنها قد تركد وجود المرض ، كما تكون إيجابية في بعض الالتهابات مثل التهاب الكبد المزمن Chronic Active Hepatitis والتهاب القولون والتليف الصفراوي الأولي Primary Biliary Cirrhosis ، وتكون نتيجة الاختبار سلبية للأشخاص الغير مصابين .
Anti Mitochondrial Antibodies :
تحليل يختصر بـ AMA دائماً يطلب هذا الاختبار للتأكد من حدوث تشخيص التليف الصفراوي الأولي Primary Biliary Cirrhosis ونسبة أقل و غير نوعية لـ Chronic Active Hepatitis و SLE و Rheumatoid Arthritis وتكون النتيجة الاختبار سلبية للأشخاص الغير مصابين .
Anti Smooth Muscle Antibodies :
يختصر باسم ASMA تكون إيجابي عالة في حالات فقر الدم و التهاب الكبد المزمن Chronic Active Hepatitis وتكون إيجابية متوسطة في حالات التهاب الكبد الحاد Acute Viral Hepatitis والتهاب المعدة المزمن Chronic Gastric وتكون نتيجة الاختبار سلبية في الأشخاص الغير مصابين .
– كل هذه الفحوصات تجرى بطريقة التألق المناعي الغير مباشر Indirect Immunofluorescent.

antigen + antibodies + anti antibodies
========


ليست هناك تعليقات:
إرسال تعليق